- N. L. R. Indika, T. Kesavan, H. W. Dilanthi, K. L. S. P. K. M. Jayasena, N. D. P. D. Chandrasiri, I. N. Jayasinghe, U. M. T. Piumika, D. M. Vidanapathirana, K. D. A. V. Gunarathne, M. Dissanayake, E. Jasinge, W. Kodikara Arachchi, D. Doheny и R. J. Desnick
Абстракт
Острая перемежающаяся порфирия — это редкое заболевание с аутосомно-доминантным типом наследования, вызванное дефицитом фермента гидроксиметилбилан-синтазы. Распознавание острых нейровисцеральных атак может быть затруднено из-за неспецифического характера симптомов.
Описание случая. В статье описывается клинический случай 33-летнего пациента, у которого отмечались рецидивирующие эпизоды сильной боли в животе, тошноты, рвоты, запора и онемения обеих нижних конечностей. Эти неспецифические нейровисцеральные приступы стали причиной ошибочных диагнозов острого аппендицита, синусовой тахикардии, камней в почках, острого лекарственного интерстициального нефрита и двух эпизодов частичной кишечной непроходимости. Шестой острый приступ вызвал подозрение на острую порфирию. Проба Уотсона-Шварца была положительной на порфобилиноген в моче. Анализ мутаций путем секвенирования ДНК, выделенной у пробанда, выявил ранее определенную миссенс-мутацию c.517C→ T, кодирующую p.R173W в гене HMBS , что подтверждает диагноз острой перемежающейся порфирии. Мутация также была выявлена у четырех из пяти членов семьи, которым был проведен таргетный мутационный анализ.
Заключение. Наиболее часто клиническая картина острой перемежающейся
порфирии характеризуется болью в животе с нейровисцеральными проявлениями, которые также наблюдаются при некоторых других соматических, психиатрических и хирургических патологиях. В связи с этим данное заболевание часто диагностируют неправильно, что приводит к неверному лечению и развитию тяжелых осложнений. Следовательно, для диагностики важны высокий уровень настороженности, а также осведомленность об основных лабораторных исследованиях. Точный диагноз
позволяет реализовать стратегии по предотвращению острых приступов, а также выполнить генетическое тестирование и провести консультирование членов семьи, относящихся к группе риска.
Сокращения
ОПП — острая перемежающаяся порфирия; ALA — аминолевулиновая кислота; ИМТ — индекс массы тела; ДНК — дезоксирибонуклеиновая кислота; HMBS — гидроксиметилбилансинтаза; PBG — порфобилиноген;
PBGD — порфобилиноген деаминаза; ПЦР — полимеразная цепная реакция.
Общие сведения
Острая перемежающаяся порфирия (ОПП) является острой порфирией с аутосомно-доминантным типом наследования. Заболевание вызвано
мутациями в гене, кодирующем гидроксиметилбилан-синтазу.
(HMBS) — третий фермент в пути биосинтеза гема. Название этого фермента используется как синоним порфобилиногендеаминазы (PBGD)[1]. На сегодняшний день выявлено более 400 мутаций в гене HMBS [2]. Наиболее частый клинический симптом — острая сильная боль в животе. При острых приступах у пациентов наблюдаются нейровисцеральные симптомы, включая рвоту, диарею, запоры, мышечную слабость, онемение, недержание или задержку мочи, сердцебиение, тремор и судороги, а также изменения поведения, такие как раздражительность, бессонница и эмоциональная лабильность.
Клинический случай
33-летний пациент поступил в специализированный госпиталь с перемежающимися болями в животе, тошнотой, рвотой, запором и онемением обеих нижних конечностей на протяжении 3-х дней. Он получал консервативное лечение в хирургическом отделении по поводу частичной кишечной непроходимости и ожидал диагностической лапароскопии. У пациента развилась спутанность сознания, также у него обнаружилась системная гипертензия, и его перевели в терапевтическое отделение для дальнейшего лечения. Пациент не страдает сахарным диабетом, артериальной гипертензии ранее не отмечалось. В анамнезе применение безрецептурных анальгетиков в течение 6 недель.
На протяжении 2-х последних лет были аналогичные нейровисцеральные приступы, потребовавшие пяти неотложных госпитализаций с постановкой различных клинических диагнозов. Шестой острый приступ вызвал подозрение на острую порфирию. Во время первого приступа в январе 2013 года был диагностирован аппендицит. Поскольку после операции симптомы ухудшились, было проведено экстренное лапароскопическое исследование.
Однако диагностическая лапароскопия не выявила причин, объясняющих
ухудшение симптомов. Второй приступ протекал в форме синусовой
тахикардии, и пациент начал получать бета-адреноблокаторы. Третий приступ, сопровождавшийся лихорадкой, был расценен как почечная колика и купирован консервативным лечением. Четвертый приступ был осложнен транзиторной гипонатриемией и преходящим повышением уровня креатинина в сыворотке. Врачи связывали эти осложнения с интерстициальным нефритом на основании того факта, что пациент принимал 50 мг диклофенака натрия два раза в сутки в течение 6 недель по назначению врача общей практики. Еще один приступ, произошедший в 2015 году, лечили как частичную кишечную непроходимость. Была выполнена диагностическая лапароскопия. Во всех этих случаях результаты ультразвукового исследования и диагностической лапароскопии не подтвердили хирургическую патологию. При осмотре пациент имел астеническое телосложение (ИМТ = 20 кг/м2), был бледным. Артериальное давление, измеренное на плечевой артерии, составило 160/90 мм рт. ст. На брюшной стенке имелись шрамы от предыдущих операций, в остальном без особенностей. Мышечная сила составила 4/5 во всех четырех конечностях (движение в полном объеме при действии силы тяжести и при небольшом внешнем противодействии).
Лабораторные исследования, проведенные во время этой госпитализации, выявили тяжелую гипонатриемию 115 ммоль/л (136-145)** с осмоляльностью сыворотки 255 мОс-моль/кг (275-295) и осмоляльностью мочи 460 мОсмоль/кг (50-1200). Концентрация креатинина в сыворотке составила 106 мкмоль/л (80-115) при уровне мочевины в крови 20 мг/дл (6-20). Концентрация гемоглобина составляла 8,2 г/дл (13,5-17,5), анемия была нормохромная и нормоцитарная. Уровень общего холестерина составлял 282 мг/дл (5-95-й центиль; 142-258) с фракцией ЛПНП 225 мг/дл (5-95-й центиль; 78-185). Уровень сывороточного ферритина составлял 646 нг/мл (20-250). Анализ газов артериальной крови указывал на метаболический ацидоз. На эхокардиограмме отмечались признаки гипертрофии левого желудочка. Результаты рентгенографии брюшной полости и УЗИ брюшной полости были без особенностей. Концентрация свинца в крови составляла 3 мкг/дл (<5). Образец мочи, взятый во время острого приступа, был отправлен для биохимического анализа. При
отстаивании образец мочи постепенно становился темно-коричневым. Проба Уотсона-Шварца была положительной на порфобилиноген (PBG) в моче (рис. 1). Спектрофотометрия мочи на содержание общего уровня порфиринов показала «пик Соре». Общий уровень порфиринов в моче, рассчитанный с использованием скорректированной по Аллену абсорбции в образце мочи, составил 5505,5 нмоль/л (<300).

Генетические исследования проводились в зарубежной лаборатории. Полный анализ гена HMBS был выполнен с помощью ПЦР-амплификации выделенной ДНК с последующим экзон-специфическим анализом методом удлинения
праймеров для всех экзонов, границ экзонов/интронов и промоторных областей.
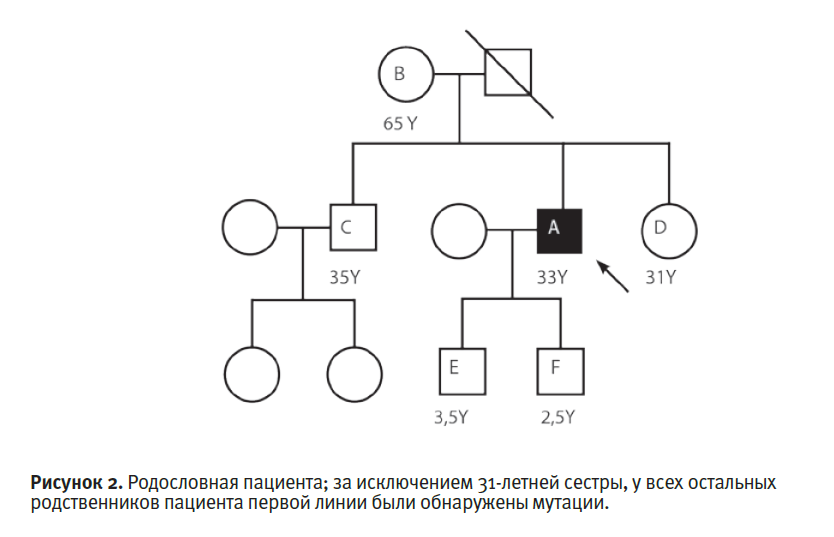
Анализ генов выявил ранее зарегистрированную миссенс-мутацию c.517C→T, кодирующую p.R173W в гене HMBS. Анализ целевых мутаций проводили путем ПЦР-амплификации выделенной ДНК с последующим анализом методом удлинения аллель-специфического праймера у пяти родственников
первой линии. Четыре из них были гетерозиготными по одной и той же
мутации гена HMBS (рис. 2 и табл.1).

Поскольку аргинат гема в Шри-Ланке недоступен, пациент получал только симптоматическое лечение. Углеводная нагрузка с внутривенным введением декстрозы и пероральным приемом углеводов была единственно возможным вариантом. Была проверена безопасность всех лекарственных препаратов, использованных для симптоматического лечения, на предмет риска острых
порфирий. Пациент был выписан из отделения, когда симптомы постепенно улучшились в течение 6 дней, для продолжения амбулаторного лечения. Оценить ответ на лечение не представлялось возможным из-за недоступности в Шри-Ланке количественных тестов для измерения аминолевулиновой кислоты (ALA) и PBG в моче.
Пациента проинформировали о факторах, провоцирующих развитие острой порфирии. Ему была предоставлена диагностическая карточка с информацией о лекарственных препаратах, применения которых следует избегать. Пациент
наблюдался в клинике с регулярным контролем функции почек, уровня гемоглобина и артериального давления. Наблюдение за пациентом в течение 1 года после постановки диагноза показало, что он перенес два легких приступа, которые не требовали стационарного лечения.
Исследования нервной проводимости не выполнялись, поскольку в интервалах между острыми приступами неврологических симптомов не наблюдалось. Родственникам, унаследовавшим мутацию HMBS, у которых не отмечалось клинических проявлений, также было рекомендовано избегать триггеров острых приступов, таких как определенные лекарственные препараты, голодание, алкоголь и гормоны. Брат пробанда получил консультацию относительно риска того, что его дети унаследуют мутацию HMBS, и рекомендацию выполнить генетическое исследование целевой мутации у обоих детей.
Обсуждение и выводы
Несмотря на то что ОПП является наиболее распространенным типом
острой печеночной порфирии, предполагаемая распространенность этого заболевания в странах Европы составляет 5,4 на 1 миллион [5]. Данные о распространенности этого заболевания в Шри-Ланке отсутствуют. Обзор литературы не выявил каких-либо предыдущих сообщений о случаях пациентов с ОПП, подтвержденной генетическим анализом, из Шри-Ланки.
Поскольку порфирии встречаются редко, клиницисты нечасто сталкиваются с этими расстройствами, а учебная программа медицинских школ уделяет им очень мало внимания. Проба Уотсона-Шварца является скрининг-тестом для анализа мочи на PBG. 2 мл мочи смешивают с равным количеством реактива Эрлиха. Если присутствует PBG, он образует комплекс порфобилиноген-реактив Эрлиха — красный хромоген, который обычно нерастворим в хлороформе и N-бутаноле. При добавлении хлороформа PBG экстрагируется и придает красный цвет верхнему водному слою, тогда как комплекс уробилиноген-реактив Эрлиха экстрагируется в слой хлороформа. Поскольку у пациентов при острых приступах выделяются большие количества PBG, ложноотрицательные результаты во время острого приступа редки. Спектрофотометрия подкисленной мочи — это полуколичественный метод, который можно использовать в качестве скринингового теста для определения общего уровня порфиринов в моче. Все порфирины имеют полосу поглощения
при длине волны около 400 нм. Хотя в Шри-Ланке сложные методы не являются широкодоступными, простые надежные лабораторные тесты весьма эффективны для постановки диагноза порфирии [6], [7]. На сегодняшний день количественные тесты для определения уровней PBG, ALA, уропорфирина и копропорфирина, а также генетические исследования на порфирию в Шри-Ланке недоступны.
Окончательный диагноз порфирии следует устанавливать в зарубежной лаборатории. Молекулярно-диагностические исследования эффективны не только для биохимического подтверждения ОПП, но и для выявления членов семьи, подверженных риску [8]. По оценкам, пенетрантность острых приступов составляет примерно 1% у гетерозигот с вероятными патогенными вариантами HMBS [9]. Ранее сообщалось о мутации R173W в Швеции, России,
Испании, Великобритании, Японии и Китае. Мутация R173W по сравнению с другими распространенными мутациями может иметь более высокую клиническую пенетрантность и повышенный риск проявления заболевания. Эта миссенс-мутация представляет собой замену C-T в нуклеотиде 517 в экзоне 10. Превращение аргинина в триптофан в мутантном белке приводит к снижению активности фермента. Несмотря на то что активность PBGD в эритроцитах может быть использована в качестве показателя тяжести заболевания, у некоторых пациентов с острыми приступами его уровни могут быть нормальными [10]-[16]. Наиболее эффективным методом лечения острых
приступов является внутривенное введение аргината гема, который доступен в Европе и многих других странах мира, но не в Шри-Ланке.
Необходимо устранение провоцирующих факторов. При легких приступах может оказаться эффективной нагрузка углеводами. При проведении терапии необходимо контролировать уровни выделения ALA и PBG с мочой, чтобы оценить ответ. Поддерживающее лечение включает наркотические анальгетики, противорвотные средства, анксиолитики, восстановление и контроль баланса жидкости и психологическую поддержку. Стратегии борьбы с рецидивирующими острыми приступами подразумевают устранение потенциальных триггерных факторов и профилактические инфузии гемина [17, 18]. Однако данный пациент столкнулся с такими проблемами, как отсутствие аргината гема для неотложной терапии и профилактики, а также отсутствие контроля за ответом на лечение путем количественного измерения уровней ALA и PBG из-за недоступности и чрезмерно высокой стоимости этих средств. Поэтому длительное разрешение симптомов у этого пациента не представляется возможным. У пациентов с острой перемежающейся порфирией обычно отмечаются острые приступы с нейровисцеральными проявлениями, которые также наблюдаются при некоторых других соматических, психиатрических и хирургических патологиях. Таким образом, пациенты с порфирией, включая острые порфирии, потенциально могут столкнуться с проблемой недостаточной и неправильно диагностики, что значительно увеличивает время между появлением симптомов и подтвержденным диагнозом, приводит к неверному лечению и потенциально серьезным необратимым инвалидизирующим последствиям и даже вплоть до
смерти.
Ошибочные клинические диагнозы у пациентов с острой порфирией могут стать причиной осложнений из-за возможного назначения порфирогенных препаратов [19]. При постановке неправильного хирургического диагноза проводятся ненужные хирургические вмешательства, такие как аппендэктомия и диагностическая лапароскопия.
Зарегистрированы сообщения о случаях ОПП с психозом в виде единственного клинического проявления [20]. У пациентов с ОПП, которым
поставлен психиатрический диагноз, могут возникнуть осложнения из-за некоторых антипсихотических средств, которые способны значительно ухудшить симптомы пациента с острой порфирией. Следовательно, для надлежащего установления диагноза важны высокий уровень настороженности, а также осведомленность о лабораторных исследованиях первой линии. Точный диагноз у пациента с ОПП позволяет реализовать стратегии по предотвращению острых приступов, а также провести скрининг и генетическое консультирование членов семьи, относящихся к группе риска.
Список литературы
- Anderson KE, Sassa S, Bishop DF, Desnick RJ. Disorders of heme biosynthesis; x-linked sideroblasticanaemia and the porphyrias. In: Scriver CR, Beaudet AL, Sly WS, et al., editors. The metabolic and molecular basis of inherited disease, vol. 2. McGraw-Hill: New York; 2001. p.2991-3062.
- Stenson PD, Mort M, Ball EV, et al. The human gene mutation database:2008 update. Genome Med. 2009;1(1):13.
- Puy H, Gouya L, Deybach JC. Porphyrias. Lancet. 2010;375:924-37.
- Whatley SD, Badminton MN. Acute intermittent porphyria. 2005 (Updated 2013 Feb 7). In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews®. Seattle: University of Washington; 1993-2017. https://www.ncbi.nlm.nih.gov/books/NBK1193/. Accessed 30 Oct 2017.
- Elder G, Harper P, Badminton M, Sandberg S, Deybach JC. The incidence of inherited porphyrias in Europe. J Inherit Metab Dis. 2013;36(5):849-57.
- Pierach CA, Cardinal R, Bossenmaier I, Watson CJ. Comparison of the Hoesch and the Watson-Schwartz tests for urinary porphobilinogen. ClinChem. 1977;23(9):1666-8.
- Rossi E. Association of clinical pathologists [ACP] best practice no 165 frontline tests for the investigation of suspected porphyria. Clin Biochem Rev.2003;24(2):67-9.
- Whatley SD, Badminton MN. Role of genetic testing in the management of patients with inherited porphyria and their families. Ann Clin Biochem. 2013;50(3):204-16.
- Chen B, Solis-Villa C, Jr Hakenberg, Qiao W, Srinivasan RR, Yasuda M, et al. Acute intermittent porphyria: predicted pathogenicity of HMBS variants indicates extremely low penetrance of the autosomal dominant disease. Hum Mutat. 2016;37(11):1215.
- Andersson C, Floderus Y, Wikberg A, Lithner F. The W198X and R173W mutations in the porphobilinogen deaminase gene in acute intermittent porphyria have higher clinical penetrance than R167W. A populationbased study. Scand J Clin Lab Invest. 2000;60(7):643-8.
- Pischik E, Mehtala S, Kauppinen R. Nine mutations including three novel mutations among Russian patients with acute intermittent porphyria. Hum Mutat. 2005;26(5):496.
- Solis C, Lopez-Echaniz I, Sefarty-Graneda D, Astrin KH, Desnick RJ. Identification and expression of mutations in the hydroxymethylbilane synthase gene causing acute intermittent porphyria (AIP). Mol Med. 1999;5(10):664.
- Whatley SD, Woolf JR, Elder GH. Comparison of complementary and genomic DNA sequencing for the detection of mutations in the HMBS gene in British patients with acute intermittent porphyria: identification of 25 novel mutations. Hum Genet. 1999;104(6):505-10.
- Yang CC, Kuo HC, You HL, Wang J, Huang CC, Liu CY, et al. HMBS mutations in Chinese patients with acute intermittent porphyria. Ann Hum Genet. 2008;72(5):683-6.
- Tomie Y, Horie Y, Tajima F, Kitaoka S, Nanba E, Yuasa I, Kawasaki H. Mutation in the exon 10 (R173W) of the hydroxymethylbilane synthase gene in two unrelated Japanese families with acute intermittent porphyria. Res Commun Mol Pathol Pharmacol. 1998;99(1):5-15.
- To-Figueras J, Badenas C, Carrera C, Munoz C, Mila M, Lecha M, Herrero C. Genetic and biochemical characterization of 16 acute intermittent porphyria cases with a high prevalence of the R173W mutation. J Inherit Metab Dis. 2006;29(4):580-5.
- Balwani M, Desnick RJ. The porphyrias: advances in diagnosis and treatment. Blood. 2012;120(23):4496-504.
- Stein P, Badminton M, Barth J, Rees D, Felicity Stewart M. Best practice guidelines on clinical management of acute attacks of porphyria and their complications. Ann Clin Biochem. 2013;50(3):217-23.
- Thunell S, Pomp E, Brun A. Guide to drug porphyrogenicity prediction and drug prescription in the acute porphyrias. Br J Clin Pharmacol. 2007;64(5):668-79.
- Ellencweig N, Schoenfeld N, Zemishlany Z. Acute intermittent porphyria: psychosis as the only clinical manifestation. Israel J Psychiatry Relat Sci. 2006;43(1):52-6.62.






